您当前的位置: 首页 > 综合资讯
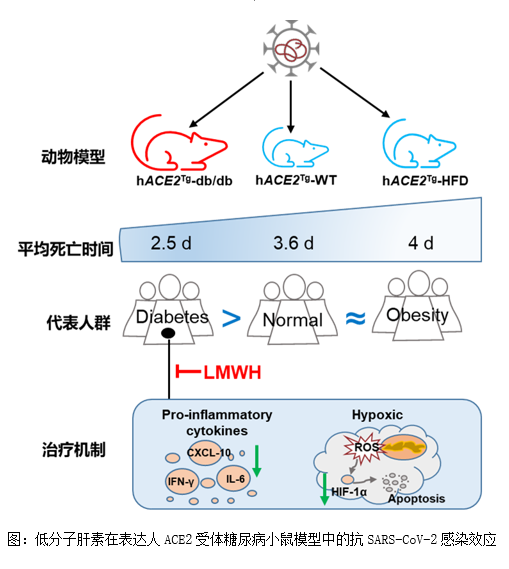
日前,中国科学院微生物研究所毕玉海研究团队和上海交通大学医学院附属瑞金医院王计秋团队合作构建hACE2糖尿病小鼠、肥胖小鼠模型,研究SARS-CoV-2对两种模型的感染致病特征,探索SARS-CoV-2对糖尿病患者的可能感染致病机制及抗凝治疗(肝素)的治疗效果,研究成果在线发表于《Zoological Research》(Anti-infection effects of heparin on SARS-CoV-2 in adiabetic mouse model)。该研究提示了低分子肝素和胰岛素联合用药在抗SARS-CoV-2感染糖尿病小鼠过程中发挥保护作用,为具有糖尿病基础病的新冠肺炎患者的治疗提供了科学依据。 糖尿病和肥胖患者在感染新型冠状病毒(severe acute respiratory syndrome coronavirus 2,SARS-CoV-2)后往往出现更为严重的临床症状,且预后较差。研究团队利用K18-hACE2转基因(hACE2Tg)小鼠模型(可感染新冠病毒),结合基因修饰、高脂饲料诱导方法分别构建了糖尿病小鼠(hACE2-Lepr-/-)及高脂饮食(HFD)诱导肥胖小鼠(hACE2-HFD)模型。在ABSL-3实验室,通过滴鼻感染SARS-CoV-2病毒,发现hACE2Tg小鼠在正常饮食、高脂诱导肥胖条件下对SARS-CoV-2的易感性相似。但是与hACE2-Lepr+/+小鼠相比,hACE2-Lepr-/-小鼠表现出更严重的肺损伤,包括炎症因子、缺氧诱导因子1α(hypoxia-inducible factor-1α,HIF-1α)表达增加,细胞凋亡增强。 研究人员以hACE2-Lepr-/-作为动物感染模型,对hACE2-Lepr-/-小鼠在鼻内感染SARS-CoV-2病毒之前,先经皮下注射低剂量(1 mg/kg)和高剂量(5 mg/kg)的低分子肝素(low-molecular-weight heparin,LMWH),每日持续给药直至小鼠安乐死。结果发现,高剂量LMWH与胰岛素联合治疗后可有效减少糖尿病小鼠的疾病进展和严重程度,减轻肺部病理变化和炎症反应。可见,较高剂量的LMWH联合胰岛素可能是治疗患有糖尿病的新冠感染患者的一种有价值的治疗方法。 中国科学院微生物研究所助理研究员张宁、上海交通大学医学院附属瑞金医院博士研究生章钟允、中国疾病预防控制中心实验动物中心研究员卢选成为该论文的共同第一作者。中国科学院微生物研究所毕玉海研究员及上海交通大学医学院附属瑞金医院王计秋教授为该论文通讯作者。高福院士、宁光院士、刘文军研究员参与指导相关工作的开展。本研究得到了中国科学院战略性先导科技专项(XDB29010102)、国家自然科学基金(91957124、32041010)、国家病原微生物资源库(NPRC-32)和中国科学院青年创新促进会(Y2021034)等项目资助。 原文链接:https://www.zoores.ac.cn/article/doi/10.24272/j.issn.2095-8137.2023.108 查看详细>>
来源: 点击量:101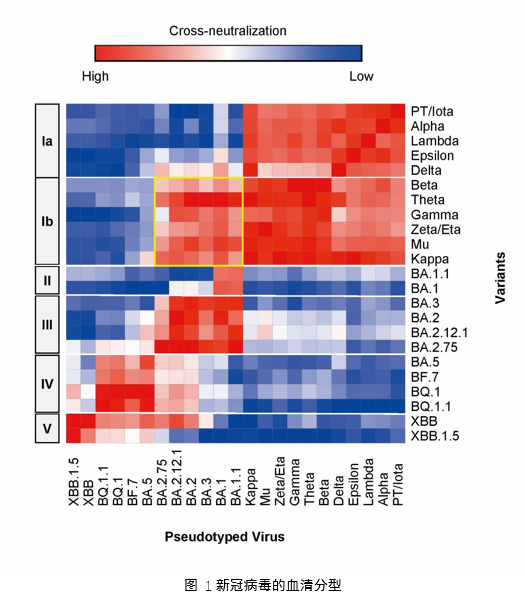
近日,中国科学院微生物研究所高福研究团队与王奇慧研究团队在Science Bulletin发表题为“Classification of five SARS-CoV-2 serotypes based on RBD antigenicities”的研究论文,对新冠病毒的变异株进行了血清分型,为未来针对新冠病毒的多价广谱疫苗和抗体的设计提供了依据,为新冠病毒的预防和治疗提供了重要科学基础。 大量研究数据表明,随着时间推移,新冠病毒变异株之间的血清交叉中和越来越弱,表明其抗原性正在不断分化,可能已进化出多种血清型。病毒的血清型是设计广谱疫苗和抗体的关键依据,在HPV疫苗等多价疫苗的研究中发挥了重要作用。对新冠病毒进行血清分型一方面可以快速归类新变异株以评估其免疫逃逸能力,另一方面可以用于设计广谱的多价疫苗和抗体,达到广谱的预防和治疗效果。 研究者基于前期开发的mRNA疫苗设计与评估平台,以小鼠血清交叉中和的方法系统研究了23种具有代表性的新冠病毒毒株的RBD抗原性,并根据抗原性的相似性划分了5种血清型。其中,I型包含了Omicron出现之前的所有变异株,且根据抗原性特点可以进一步分为Ia和Ib两个亚型。II-V型则涵盖了处于不同进化阶段的多种Omicron亚型,包括BA.1,BA.2,BA.5和XBB等。基于不同血清型的抗原性数据(图1),即可方便的选取具有代表性的毒株作为抗原设计多价广谱疫苗和抗体,也可以对新型变异株进行归类以快速评估其免疫逃逸能力。 中国科学院微生物研究所与山西农业大学联合培养的博士生胡世雄、微生物所与云南大学联合培养硕士生吴春丽、北京大学博士生吴鑫凯为论文共同第一作者,微生物所高福院士、王奇慧研究员、杜沛副研究员,以及北京大学陆剑教授为论文共同通讯作者。该研究得到了国家重点研发计划、国家自然科学基金和中国科学院等相关项目的经费支持。 论文链接:https://www.sciencedirect.com/science/article/pii/S2095927323006837 查看详细>>
来源: 点击量:88
引起COVID-19的SARS-CoV-2病毒会导致严重的急性呼吸道综合征,这或许就与2019年出现的已知会引起轻度季节性感冒的其它冠状病毒形成了对比,同时还提出了一个问题,即为何一种冠状病毒对人类所产生的影响要比另外一种更为严重,近日,一篇发表在国际杂志Nature上题为“TMPRSS2 is afunctional receptor for human coronavirus HKU1”的研究报告中,来自巴斯德研究所等机构的科学家们通过研究提供了部分答案,同时识别出了季节性冠状病毒HKU1进入人类细胞中的通道。 HKU1所结合的受体与SARS-CoV-2不同,这或许能部分解释两种冠状病毒严重程度的差异,受体能作为一种有用的方法来帮助阐明冠状病毒的传播和病理学特征,其能作为病毒进化监测工作的一部分。目前已知能感染人类的冠状病毒有7种,其中4种通常被认为致病性较为轻微,包括HKU1,229E,NL63和OC43,另外三种具有较强的致病性,包括SARS-CoV-1,Mers-CoV和SARS-CoV-2。早在2005年,研究人员首次从来自香港的一名患有严重肺炎的老人身上分离到了HKU1,与SARS-CoV-2一样,HKU1主要会感染机体的上呼吸道细胞,然而,其很少会感染肺部的支气管和肺泡,HKU1病毒会引起感冒和其它轻微的呼吸道症状。同时患者也可能会出现并发症,包括严重的呼吸道感染,特别是在幼儿、老年人和免疫功能低下的个体中,据估计,有70%的儿童会在6岁之前发生感染,目前全球共有75%-95%的人群暴露过HKU1,这或许与其它季节性人类冠状病毒相当。 在细胞水平上,冠状病毒的刺突蛋白当与受体结合后会被切割或分裂成两半,这种分裂现象对于病毒的融合、进入和增殖至关重要,一些冠状病毒(比如SARS-CoV-2和NL63)能使用ACE2受体来作为进入细胞的门户,到目前为止,HKU1和OC43是唯一具有未知受体的冠状病毒。这项研究中,研究人员通过联合研究识别出了TMPRSS2酶类或能作为HKU1进入细胞的受体,一旦结合作用发生,TMPRSS2就会诱发HKU1与细胞发生融合,从而导致病毒感染,通过使用多种技术组合在体外和细胞培养物中进行试验,研究人员发现,TMPRSS2受体与HKU1刺突具有较高的亲和力,而SARS-CoV-2则不是这种情况。 研究者Olivier Schwartz说道,一旦识别出了病毒的受体,我们就有可能更加准确地表征靶细胞,同时也能更深入地了解病毒的进入、增殖机制以及感染的病理生理学特征;本文研究还揭示了冠状病毒所采用的多种进化策略,其能使用TMPRSS2与靶向细胞结合或诱发病毒与靶向细胞的融合以及病毒的进入。这些人类致病性病毒能使用不同的受体来影响其致病的严重程度,受体的水平在呼吸道细胞中也有所不同,从而就会影响细胞对感染和病毒传播的敏感性;一旦知晓病毒进入细胞的途径,研究人员就有可能通过开发靶向性疗法并评估未来任何新出现的冠状病毒所构成的毒力风险来更加有效地对抗感染。 与此同时,研究人员还开发并且揭示了一种纳米抗体,其能通过结合TMPRSS2受体来抑制HKU1的感染,这些制剂因其存在的潜在治疗性活性目前已经获得了相应的专利。综上,本文研究结果揭示了冠状病毒的多种进化策略,其或能利用TMPRSS2来直接结合靶向细胞或引导刺突进行病毒的膜融合及进入靶向细胞。 原始出处: Saunders,N.,Fernandez,I.,Planchais,C.et al.TMPRSS2 is afunctional receptor for human coronavirus HKU1.Nature(2023).doi:10.1038/s41586-023-06761-7 查看详细>>
来源: 点击量:355
Excision BioTherapeutics在第30届欧洲基因与细胞治疗学会(ESGCT)年会上上介绍了正在进行EBT-101治疗艾滋病的1/2期临床试验的积极中期数据。 这是一款基于CRISPR-Cas9基因编辑的艾滋病疗法,也是全球首个使用CRISPR基因编辑治疗艾滋病的人体临床试验,该疗法于2021年底获得美国FDA批准进行人体临床试验。 该公司表示,建立EBT-101的安全性和生物分布是临床计划中重要的第一步。在前三名临床试验参与者中,使用EBT-101治疗没有导致严重的不良事件或剂量限制毒性,所有报告的不良事件都是轻微和可逆的。此外,所有参与者的血液中检测到EBT-101,治疗产生了积极的生物分布。这些初步观察提供了重要的临床数据,支持将该临床试验推进到下一个剂量水平(从9.0x1011vg/kg提高到3.0x1012vg/kg)。 Excision公司首席执行官Daniel Dornbusch表示,Excision致力于为感染性疾病患者开发基于CRISPR的治愈性疗法。EBT-101是一种基于CRISPR的基因疗法,正在测试作为艾滋病的功能性治愈的潜在疗法。我们认为,分享这一初步安全性和生物分布数据对艾滋病群体,以及正在开发的其他适应症的基因疗法来说很重要。 艾滋病(AIDS),全称是获得性免疫缺陷综合征,这是一种由人类免疫缺陷病毒(HIV)引起的、危害性极大的传染病。HIV病毒可以攻击并严重破坏人体免疫系统,因此艾滋病患者常常因免疫能力不足而发生二次感染或罹患肿瘤,这也使得艾滋病患者的死亡率极高。 据联合国艾滋病规划署数据,全球范围内HIV携带者和艾滋病患者人数从2013年末的3430万人增至2018年末的3800万人,且数量仍在快速增长。 虽然,抗逆转录病毒疗法(ART)的不断进步使得艾滋病患者的寿命和预后大大延长,但也会带来严重的副作用,以及出现耐药性。 更重要的是,HIV作为一种逆转录病毒,它可以将其基因组整合到宿主细胞的染色体上,这意味着当前的抗逆转录病毒疗法只能抑制病毒,无法彻底清除体内的HIV病毒,也就无法彻底治愈艾滋病。 Excision公司表示,现有的艾滋病标准治疗方法是抗逆转录病毒疗法,该疗法可以防止HIV病毒在体内的复制,但无法清除HIV病毒,患者需要长期持续接受治疗,会导致严重的副作用并影响患者生活质量。而基于CRISPR基因编辑技术的疗法则有望取代当前的抗逆转录病毒疗法,实现对艾滋病的“彻底治愈”。 2020年11月,美国天普大学和内布拉斯加大学医学中心的研究人员在Nature Communications期刊上发表研究论文。成功地在非人灵长类动物的基因组中编辑并清除了与HIV密切相关的SIV-a病毒,这在艾滋病研究中迈出了重要一步。这一突破也使得人类比以往任何时候都更接近于开发出彻底治愈艾滋病的方法。 这项研究突破意味着人类已经找到了有望彻底终结艾滋病噩梦的新方法。Excision公司获得了天普大学的授权进行临床研究开发。 众所周知,CRISPR-Cas9基因编辑能够精准地对DNA双链进行切割,导致DNA双链断裂,基于这一原理,我们可以通过CRISPR-Cas9对已经整合到人体染色体中的HIV病毒基因组进行切割。 但是,如果只切割一个位点,那么它们很容易进行修复,而且容易导致被切割位点附近发生基因变异。该疗法则使用了多次切割,以彻底打碎HIV病毒基因组,从而实现对HIV病毒的彻底清除。 此前在非人类灵长类动物中进行了测试表明,使用腺相关病毒(AAV9)载体递送的CRISPR-Cas9系统可以到达广泛到达骨髓、淋巴结、脾脏等病毒所在的组织,尤其是HIV病毒的重要宿主细胞CD4+T细胞,进而清除其中的病毒。 除了基于CRISPR的艾滋病疗法之外,该公司的研发管线还包括使用CRISPR技术清除乙肝病毒(HBV)、单纯疱疹病毒(HSV)、乳头多瘤空泡病毒(JCV)。 Excision公司的研发管线 查看详细>>
来源: 点击量:251